苏州高新区人民医院,江苏 苏州 215000
摘 要
硝苯地平缓释片现行释放度检查标准中,除个别厂家采用UV法测定释放量外,其他企业标准均采用HPLC法测定释放量。
采用UV法测定样品的释放量,灵敏度较低。规格为5毫克的样品释放量按百分百计,供试液的紫外吸光度值约为0.16,一小时的释放量按规定释放范围的上限(百分之二十)计,供试品溶液的紫外吸光度值约为0.031,不易达到准确测定的要求。
在所有测试的企业中,有个别厂家UV法测定释放量有问题,主要体现在灵敏度低、不易达到准确测定,综合各企业现行释放度测定方法UV法和HPLC法测定释放量,我院对此两种方法分别进行了比较,统一建立了硝苯地平缓释片释放量的HPLC测定方法。
Abstract
In the current release inspection standards of nifedipine sustained-release tablets, except for the UV method used by some manufacturers to determine the release amount, other enterprise standards adopt HPLC method to determine the release amount.
UV method was used to determine the release of the sample, but the sensitivity was low. The release amount of 5mg sample is calculated as 100%, and the uv absorbance value of the test solution is about 0.16. The release amount of 1 hour is calculated as the upper limit of the specified release range (20%), and the UV absorbance value of the test solution is about 0.031, which is difficult to meet the requirements of accurate determination.
In view of the low sensitivity of UV method for the determination of release in some manufacturers, it is difficult to achieve accurate determination. Based on the existing determination methods of release in various enterprises, our hospital compared the determination of release by UV method and HPLC method, and established a unified HPLC method for the determination of release of nifedipine sustained release tablets.
关键词:硝苯地平、释放量、测定方法
Key words: nifedipine, release amount, determination method
1、 色谱条件
色谱柱:日本岛津 VP-ODS C18柱(150毫米×4.6毫米 5微米);流动相:乙腈-甲醇-磷酸盐缓冲液[取磷酸溶液(6.5毫升→100毫升)8.0毫升,15.6%NaH2PO4溶液50毫升,加水950毫升,让其混合均匀 (2:1:2)为流动相;检测波长:254nm;流速:1.0mL·min-1;柱温:35℃。理论板数按硝苯地平主峰计算最起码应不得低于2300。
2、 释放方法
参照《中国药典》2020版四部附录,进行本品的收集,通过溶出度测定法第二法的装置,选择介质为0.4%缓冲液C16H33(CH3) 3NBr磷酸盐[1](pH=6.5)500毫升,转轴速度摸索条件设定为每分钟两百转。随后过滤溶液分别选择在第一个小时、第四个小时以及第七个小时分别单独进行,并在过滤后补充同种溶液五毫升,将其作为用来测定的供试品溶液。
3、 UV法
通过UV法,选取362纳米和450纳米两个不同的波长,分别对试供品溶液进行吸光度测试,其中A=A362−A450
。与此同时,称取在条件105摄氏度下干燥且恒重的硝苯地平缓释片的对照品,采用上述同等溶液进行稀释,最终达到每毫升十微克的溶液[2],分别在不同时间节点下对其进行测试。
4、 HPLC法
(1) 对照品溶液的制备
用精密电子天平称取10.26毫克的硝苯地平缓释片的对照品,并放置于刻度容量为100毫升的容量瓶中,第一步先加入少许乙醇进行溶解,直至容量瓶最大限度,在此过程中保证均匀稀释,并将其作为贮备液;随后称取适容量的稀释后的溶液,加入溶出介质实现含10.26微克的硝苯地平缓释片参照溶液。
(2)测定法
称取对照品与试验品溶液各20毫升,用相同的检测条件测量,并记录结果。见图1 。
5、 空白辅料的干扰试验
将辅料先混合,取两片并一起放置于试验瓶中,加入适量的上述同等溶出介质,然后定容至100毫升。使其保温37摄氏度,进行同步稀释,直至到达容量瓶最大限度,让其均匀稀释后称取10mL,在次放置于容量为100mL的试验瓶中,重复上述步骤进行均匀稀释,最后取出适量溶液参展色谱条件进行观察,实验发现硝苯地平的测定过程中不会受到辅料的干扰。典型色谱图见图1。
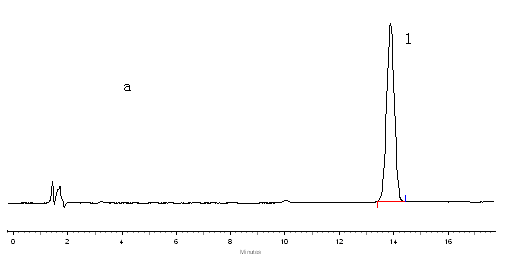
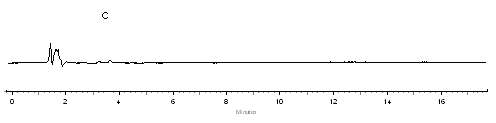
a.对照品 c辅料;1.硝苯地平
图1 硝苯地平缓释片释放度测定的HPLC图谱
6、 线性的考察
称取硝苯地平对照品贮备液8次,含量分别为0.5毫升,1毫升,3毫升,5毫升,8毫升,10毫升,15毫升,20毫升,加入上述同等品质的溶出介质,稀释完成后的硝苯地平含量为平0.513,1.026,3.078,5.13,8.208,10.26,15.39,20.52µg的溶液,依次进样,按上述色谱条件测定,以硝苯地平对照品浓度(C)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,其回归方程A = 2.4082103C – 4.827410-3,r =0.9999,结果表明硝苯地平在0.513~20.52µg·mL - 1范围内,线性关系良好。
7、 精密度试验
称取20µL的“2.4”中对照品溶液,连续进样5次,并记录色素峰面积。结果,RSD值为0.26%(n=5),表明精密度良好。
8、 稳定性试验
取7小时取样制得的供试品溶液[3],分别于0,2,4,6,8,16,24小时精确吸取20µL,进样,记录色谱峰面积,结果见表7-2:RSD值为0.51%(n=7),能够表明供试品溶液在24小时内的稳定性较高。
9、 溶出度回收率
称取3种剂量的硝苯地平对照品,分别为5mg、7.5mg、10mg,共计9份。将其放置于容量为1L的试验瓶中,根据处方比例,事先将辅料适量的混合以及溶出介质,使其保温37摄氏度,进行同步稀释,直至到达试验瓶最大刻度线,取出适量实验溶液与对照品溶液,进行对比测定。
10、 UV法和HPLC法测定样品释放度结果比较
UV法和HPLC法[4] 分别用来测定比较检测方法的差异,对于溶出时间分别在1小时,4小时,7小时取样,需要过滤的过滤取滤液测定分析, 两种不同的检测方法测定样品释放度,通过数据分析,确实存在一定的差异,HPLC法释放量测定的数据均一性明显是要好于UV法。在不同方法进行测定的过程中,取一份采用UV法测定采集的数据,第一个小时取样溶液重复测定,A=A362nm-A450 nm极大值和极小值,两个值测定下来分别为0.022081,0.022090,相对偏差为百分之二点一九。说明了从测定准确度方面判定,UV法达不到规定的要求,那么带来的问题和隐患就是:判定边缘批次时,结果将很难准确可控。
11、结论:
所建HPLC方法较UV法灵敏度高,经方法学验证,准确度、精密度、线性良好,可用于硝苯地平缓释片体外释放量的测定。
参考文献:
[1] 李振军, 刘德宾, 姜君, & 崔慧颖. (2015). 硝苯地平缓释片(i)释放度检查影响因素研究. 医药前沿, 5(16), 2。
[2] 张信中, 吴娟, 张洪. 基于粉末直接压片工艺的硝苯地平缓释片:制备,体外释放度及比格犬体内药动学评价[J]. 国际药学研究杂志, 2009, 36(003):210-213.
[3] 刘景宜. 硝苯地平缓释片Ⅱ释放度检测方法研究[J]. 首都食品与医药, 2021, 28(11):2.
[4] 向军涛, 蒋琳兰. 硝苯地平骨架缓释片的制备及体外释放度的考察[J]. 广东药学院学报, 2006, 22(5):3.